segunda-feira, 18 de novembro de 2013
sábado, 16 de novembro de 2013
Química 1º C
ARY
DE OLIVEIRA GARCIA
Nome:_________________________Nº:____
SÉRIE: 1º C – 4º BIMESTRE
ATIVIDADE
AVALIATIVA: QUÍMICA
1)
Calcule o valor das massas molares: (2,0)
Dados:
Mg = 24; S = 32; O = 16; H = 1; Na = 23
a) MgSO4 . 7
H2O b) Na2SO4
.10 H2O
2)
A celestita (SrSO4) reage com carbonato de sódio (Na2CO3)
tendo como produtos carbonato de estrôncio (SrCO3) e sulfato de
sódio (Na2SO4) conforme reação:
SrSO4
(s) + Na2CO3 (aq) → SrCO3 (s) + Na2SO4
(aq)
Qual
é a massa de carbonato de estrôncio que
pode ser obtida pela reação completa de 1 mol de celestita, em gramas? (2,0)
Dados:
Sr = 87,6; S = 32; O = 16; C =12; Na = 23
3)
Considere que a cotação do ouro seja R$ 22, 50 por grama. Que quantidade de
átomos de ouro, pode ser adquirida com R$ 2000,00? (2,0)
Dado:
Massa molar do Au = 197g/mol; Constante de Avogadro = 6 . 1023
4)
Dada a equação não-balanceada: Ca3(PO4)2 + H2SO4 → H3PO4
+ CaSO4
Partindo-se
de 31g de Ca3(PO4)2 e usando-se quantidade
suficiente de H2SO4, qual, em gramas, a massa aproximada
de H3PO4 obtida? (2,0)
Dados:
H = 1u; O = 16u; P = 31u; Ca = 40u.
5)
Considere a equação não-balanceada: Fe2O3
+ C →
Fe + CO
Utilizando-se
9,6 toneladas de minério, a quantidade de ferro produzida será de: (2,0)
Dados:
C = 12; O = 16; Fe = 56
quarta-feira, 23 de outubro de 2013
FÍSICA 1ºs G, H, I, J - EXERCÍCIOS: FORÇA GRAVITACIONAL
Olá meus queridos! Seguem exercícios para verificarem a aprendizagem... Como combinamos, imprimam ou copiem e tentem resolver ok?!? Espero que achem fácil... Abraço!
1) A força de atração gravitacional entre a Terra e nosso corpo nos “prende” à superfície do planeta. Essa força faz com que parte de nossos músculos seja exigida constantemente. Se a força gravitacional não existisse, o que aconteceria aos músculos do coração? Pesquise e responda.
1) A força de atração gravitacional entre a Terra e nosso corpo nos “prende” à superfície do planeta. Essa força faz com que parte de nossos músculos seja exigida constantemente. Se a força gravitacional não existisse, o que aconteceria aos músculos do coração? Pesquise e responda.
2) Qual é o módulo aproximado da força
de atração gravitacional atuando entre uma garota com massa de 50 kg e um rapaz
de 70 kg que estejam situados a 3,5 m um do outro?
Dado: G = 6,7 . 10-11 N.m2/kg2
3) Io é um satélite natural de Júpiter
onde ocorrem atividades vulcânicas. Dizem os cientistas que uma das razões para
a ocorrência dessas atividades é a forte atração gravitacional exercida por
Júpiter, que acaba por causar deformações no satélite. A massa de Io é de 9 .
1022 Kg e a distância orbital média é igual a 4. 105 Km. Qual
é o módulo da força gravitacional média entre Júpiter e Io? Dados: G = 6,7 . 10-11
N.m2/kg2; massa de Júpiter = 2 . 1027 kg
4) Qual é a grandeza física que não
interfere nas três leis de Kepler?
a) distância
b) tempo
c) massa
d) velocidade
e)
raio da trajetória
5) Qual a intensidade do campo gravitacional
da Terra sobre a Lua? Dados: G = 6,7 . 10-11 N.m2/kg2; MTerra = 5,98 . 1024 Kg;
MLua
= 7,36 . 1022 Kg; R Terra-Lua = 3,82 . 108 m
6) Os cientistas que se seguem deram
importantes contribuições para nosso conhecimento atual do movimento dos
planetas:
1.
Copérnico
2. Ptolomeu
3. Kepler
Se
os nomes desses homens forem arranjados em ordem do começo de suas
contribuições, com a primeira contribuição colocada antes, a ordem correta
será:
a) 1, 2, 3
b) 2, 3, 1
c) 3, 1, 2
d) 1, 3, 2
e) 2, 1, 3
7) Considere uma estrela em torno da
qual gravita um conjunto de planetas. De acordo com a 1ª lei de Kepler:
a)
Todos os planetas gravitam em órbitas circulares.
b) Todos os planetas gravitam em órbitas
elípticas em cujo centro está a estrela.
c) As órbitas são elípticas, ocupando a
estrela um dos focos da elipse; eventualmente, a órbita pode ser circular,
ocupando a estrela o centro da circunferência.
d) A órbita dos planetas não pode ser
circular.
e) A órbita dos planetas pode ter a
forma de qualquer curva fechada.
8) Numa cozinha, 3 m separam uma mesa de
madeira de uma geladeira. Sendo a massa da geladeira 30 kg e da mesa 10 kg.
Calcule o valor da força de atração gravitacional entre elas.
Dado: G = 6,7.
10-11 N.m2/kg2
9) Dois navios de 300.000 toneladas cada
estão separados por uma distância de 100 metros. Calcule o valor da força de
atração gravitacional entre eles. Dado: G = 6,7. 10-11 N.m2/kg2
FÍSICA 1ºs: MÚSICA PARA MEMORIZAR...
Olá pessoal! Para facilitar o entendimento dos modelos Geocêntrico e Heliocêntrico, e Força Gravitacional segue um link... espero que gostem!!! Abraço!
http://www.testandotesteweb.xpg.com.br/Fisica-Pachecao/Galileu_e_eu.mp3
http://www.testandotesteweb.xpg.com.br/Fisica-Pachecao/02.Beleza%20Arrasadora(ForcaGravitacional).mp3
http://www.testandotesteweb.xpg.com.br/Fisica-Pachecao/Galileu_e_eu.mp3
http://www.testandotesteweb.xpg.com.br/Fisica-Pachecao/02.Beleza%20Arrasadora(ForcaGravitacional).mp3
segunda-feira, 21 de outubro de 2013
QUÍMICA 1ºs: Exercícios
Olá pessoal! Seguem alguns exercícios para otimizar nosso tempo em sala de aula... Se puderem imprimam, colem nos cadernos e tentem resolver... Espero que achem fáceis! Abraço!!!
1) (FUVEST) – Quantos mols de hidrogênio
se obtêm por eletrólise de 108 g de água?
Eletrólise da água: H2O → H2 + ½ O2
(Dado: massa molar da água = 18 g/mol)
2) (FUVEST) – Considere a transformação
de ozônio em oxigênio comum representada pela equação:
2 O3 → 3 O2
Determine a massa de oxigênio produzida
quando 96 g de ozônio se transformam completamente.
3) (FUVEST) – A produção de carboidratos
(fórmula mínima CH2O) pelas plantas verdes obedece à equação geral
da fotossíntese: CO2 + H2O → CH2O
+ O2
Quantos litros de gás carbônico, medido
nas CNTP, serão necessários para produzir 10 g de carboidrato?
(Dado: volume molar dos gases nas CNTP =
22,4 L/mol; massa molar do CH2O = 30 g/mol)
4) (UNICAMP) – Um medicamento contém 90
mg de ácido acetilsalicílico (C9H8O4) por
comprimido.
Quantas moléculas dessa substância há em
cada comprimido?
(Dado: Massa molar do C9H8O4
= 180 g/mol).
5) (FUVEST) – Uma das maneiras de
impedir que o SO2, um dos responsáveis pela “chuva ácida”, seja liberado para a
atmosfera é tratá-lo previamente com óxido de magnésio, em presença de ar,
como equacionado a seguir: MgO(s) + SO2 (g)
+ ½ O2 (g) → MgSO4 (s)
Quantas toneladas de óxido de magnésio
são consumidas no tratamento de 9,6 ∙ 103 toneladas de SO2?
(Dadas as massas molares em g/mol: SO2
= 64; MgO = 40)
6) (UNICAMP) – A equação a seguir representa
a obtenção de ferro pela reação de hematita com carvão:
Fe2O3 + 3 C → 2 Fe
+ 3 CO
(Dados: Massa molar do Fe2O3
= 160 g/mol; Massa molar do Fe = 56 g/mol)
a) Quantos quilogramas de hematita são
necessários para produzir 1120 kg de Fe?
7) (UNICAMP) – Antiácido é um produto farmacêutico
utilizado para reduzir acidez estomacal provocada pelo excesso de ácido
clorídrico, HCl. Esse produto farmacêutico pode ser
preparado à base de bicarbonato de sódio, NaHCO3, que reage com o
ácido clorídrico conforme a equação:
HCl + NaHCO3 → NaCl + H2O
+ CO2
Considerando que uma dose do antiácido
contém 2,52 g de bicarbonato de sódio, calcule o número de mols de ácido
neutralizados no estômago. (Dado: Massa molar do NaHCO3
= 84 g/mol).
8) (Faap-SP) A combustão completa do
metanol pode ser representada pela equação não-balanceada:
CH3OH(l) + O2(g)
→ CO2(g) + H2O(l)
Quando se utilizam 5,0 mols de metanol
nessa reação, quantos mols de CO2 são produzidos?
a) 1,0. b) 2,5. c) 5,0. d) 7,5. e) 10
9) (F. Dom Bosco-DF) Dada a equação
química não-balanceada: Na2CO3 + HCl → NaCl
+ CO2 + H2O
A massa de carbonato de sódio que reage
completamente com 0,25 mol de ácido clorídrico é:
Dado: Na2CO3 = 106
g/mol.
a) 6,62g. b) 25,5g. c) 13,25g. d) 10,37g. e) 20,75g.
sábado, 19 de outubro de 2013
QUÍMICA (1ºs): Prevendo quantidades de reagentes e produtos
Olá meus queridos! Para que vocês entendam com mais facilidade os cálculos de nosso conteúdo, segue uma simulação para treinarem... Espero que se saiam bem!!! Prontos?!?
http://www.labvirtq.fe.usp.br/simulacoes/quimica/sim_qui_bolo.htm
http://www.labvirtq.fe.usp.br/simulacoes/quimica/sim_qui_bolo.htm
QUÍMICA (1ºs) - MOL
Olá pessoal! Para quem ainda tem alguma dúvida sobre cálculo de massa molecular, mol, segue um vídeo... Espero que curtam... Um abraço!
1ºs G, H, I, J - Física Modelos Geocêntrico e Heliocêntrico
Olá pessoal! Segue um vídeo... Espero que gostem!
segunda-feira, 16 de setembro de 2013
1º H _ Atividade Mensal de Química
Olá meus queridos! Recomendações: Imprimam essa folha acertando no word Ok?!? Resolvam e me entreguem amanhã (17/09) após o provão... Não receberei a atividade em folhas de caderno, bem como em almaço... assim temos uma atividade padronizada... Ah! O principal... só até amanhã!!!
Beijos, estudem...
Beijos, estudem...
E. E. PROF. ARY DE OLIVEIRA GARCIA
Nome:__________________________ Nº:________ Série: 1º___
3º Bimestre
ATIVIDADE AVALIATIVA MENSAL: QUÍMICA
1) Os coeficientes estequiométricos da equação abaixo
são:
___Br2
+ ___KOH →___KBrO3 + ___ KBr
+ ___H2O
2) Dada a equação: Na2Cr2O7 + __
SO2 + H2O →__Cr(OH)SO4 + Na2SO4
Acerte os
coeficientes das lacunas de modo que estabeleça o balanceamento.
3) Considere as
seguintes equações químicas:
a) 1 C12H22O11 → 12 C +
11 H2O
b) 1 KClO4 → 1 KCl + O2
c) 2 Fe + 3 H2SO4 → Fe2 (SO4)3
+ 3 H2
d) NaHCO3 → Na2CO3 +CO2
+H2O
Quais estão devidamente balanceadas? ___________________
4) Balanceie a equação abaixo:
__H2S + __HNO3 →__ H2SO4
+ __ NO2 + __H2O
terça-feira, 10 de setembro de 2013
1ºs :Atividade Mensal Avaliativa de Química
Olá meus queridos! Segue a atividade mensal... Imprimam organizando no Word essa folha, resolvam e a entreguem até 14/09 ok?!
Após essa data não estarei recolhendo mais, em função do tempo devido a correção! Resolvam com atenção, seguindo os conceitos estudados em aula! Que todos tenham um aprendizado significativo...
Um abraço!
Profª. Edileyne
Após essa data não estarei recolhendo mais, em função do tempo devido a correção! Resolvam com atenção, seguindo os conceitos estudados em aula! Que todos tenham um aprendizado significativo...
Um abraço!
Profª. Edileyne
E.
E. Prof. Ary de Oliveira Garcia
Nome:___________________Nº:______3º Bimestre
Série:
1º___Data:__/__/20___NOTA:_____________
ATIVIDADE AVALIATIVA: QUÍMICA
Orientações:
Apresentar as resoluções! Respostas a caneta azul ou preta! Rasuras anulam a
questão!
1)
A soma dos coeficientes estequiométricos para a equação química abaixo
balanceada é:_____________
FeCl3 +
NH4OH → Fe(OH)3 + NH4Cl
2)
Dada a equação: Cu(OH)2 + H4P2O7 → Cu2P2O7 + H2O
Os
coeficientes que a balanceiam, são
respectivamente:________________
3)
6 NaN3 (s) + Fe2O3 (s) → Na2O (s) +
2 Fe (s) +N2↑ (g)
Após
o balanceamento da equação, a soma de todos os coeficientes mínimos e inteiros
das espécies químicas envolvidas é igual a:
a)
16 b) 20 c) 22 d) 8
4)
Dada a equação: Na2Cr2O7 + SO2 + H2O
→ Cr(OH)SO4 + Na2SO4
Depois
de balanceada com os menores coeficientes inteiros possíveis, ela apresenta
como soma:________________________________
5)
Os coeficientes estequiométricos da equação a seguir já balanceada, é
respectivamente:___________________
Na2CO3 + H3PO4
Na3PO4
+ H2O + CO2
quinta-feira, 1 de agosto de 2013
VOCÊ SABE COMO É CALCULADO A NOTA DO ENEM?
Olá meus queridos!
Daqui a pouco temos prova do Enem, Saresp, Fuvest, Unesp, Unicamp e por ai vai... Mas como é feito o cálculo da nota de cada candidato no caso do Enem? Você já parou para pensar nisso? Vamos saber um pouquinho mais...
Eles não avaliam todas as questões da mesma forma. Eles utilizam a coerência das respostas. As notas são definidas em uma escala criada especialmente para o Enem e mede a proficiência (competências e habilidades) do estudante nas áreas de conhecimento: Matemática e suas tecnologias; Linguagens, códigos e suas tecnologias; Ciências da Natureza e suas tecnologias; e Ciências Humanas e suas tecnologias.

As questões respondidas pelo participante são colocadas numa régua que estabelece uma unidade de medida padrão do conhecimento. As questões são avaliadas de acordo com a posição em uma escala de proficiência, a nota do participante é medida nessa escala. “Outro aspecto importante no cálculo da nota é que as notas mínima (nenhum acerto) e máxima (45 acertos) dependem do grau de dificuldade da prova”. Assim, a nota mínima não é zero e a máxima não é mil. O mínimo e máximo dependem das questões que compõem a prova.
AVALIAÇÃO

Daqui a pouco temos prova do Enem, Saresp, Fuvest, Unesp, Unicamp e por ai vai... Mas como é feito o cálculo da nota de cada candidato no caso do Enem? Você já parou para pensar nisso? Vamos saber um pouquinho mais...
Eles não avaliam todas as questões da mesma forma. Eles utilizam a coerência das respostas. As notas são definidas em uma escala criada especialmente para o Enem e mede a proficiência (competências e habilidades) do estudante nas áreas de conhecimento: Matemática e suas tecnologias; Linguagens, códigos e suas tecnologias; Ciências da Natureza e suas tecnologias; e Ciências Humanas e suas tecnologias.

As questões respondidas pelo participante são colocadas numa régua que estabelece uma unidade de medida padrão do conhecimento. As questões são avaliadas de acordo com a posição em uma escala de proficiência, a nota do participante é medida nessa escala. “Outro aspecto importante no cálculo da nota é que as notas mínima (nenhum acerto) e máxima (45 acertos) dependem do grau de dificuldade da prova”. Assim, a nota mínima não é zero e a máxima não é mil. O mínimo e máximo dependem das questões que compõem a prova.
AVALIAÇÃO
O modelo de avaliação leva em conta três informações:
a) Parâmetro de discriminação - poder que a questão possui de diferenciar a habilidade dos candidatos no conteúdo.
b) Parâmetro de dificuldade – a dificuldade da habilidade exigida no item.
c) Parâmetro de acerto casual – o candidato pode acertar uma questão por acaso, esse parâmetro representa essa probabilidade.
a) Parâmetro de discriminação - poder que a questão possui de diferenciar a habilidade dos candidatos no conteúdo.
b) Parâmetro de dificuldade – a dificuldade da habilidade exigida no item.
c) Parâmetro de acerto casual – o candidato pode acertar uma questão por acaso, esse parâmetro representa essa probabilidade.
As questões passam por cinco etapas. Primeiro os itens são elaborados, depois ficam armazenadas no banco de questões. O terceiro passo é a aplicação do pré-teste, realizado pelo Inep em escolas de todo o país. O resultado é avaliado e as questões são classificadas. As questões adequadas seguem para a elaboração da prova.

Na escala utilizada no Enem, leva-se em conta a coerência pedagógica. A Teoria de Resposta ao Item acredita que se o participante acertou as mais difíceis, deve acertar as mais fáceis. Toda prova terá questões fáceis, intermediárias e difíceis, justamente para que o aluno possa ser avaliado e suas respostas possam ser comparadas e colocadas na régua. É importante salientar que se for identificado que as respostas não foram coerentes, é considerado que podem ter sido acertadas ao acaso, então “os acertos acrescentarão menos na nota do participante”, segundo o Guia.
REFERÊNCIA:
Disponível em: <http://educacao.globo.com/enem/assunto/prova-do-enem/guia-do-participante-explica-nota-do-enem.html> Acesso em: 01. Ago. 2013
PORTAL E.M. DIÁLOGO - Juventudes Conectadas
Olá meus queridos! Nesse retorno, recebi do Sr. Luiz um artigo que ele disse ser interessante acrescentar no blog... cheguei, fui me inteirar do assunto antes de colocar algo para vocês, como me é de costume...
O que diz o artigo? Ele aborda a criação de um portal aberto de interação entre escolas, alunos, professores, pesquisadores objetivando uma atratividade por parte do alunado através das tecnologias digitais. Leiam um trechinho retirado do artigo:
"A Proposta do Portal EM diálogo é de que jovens do ensino médio sejam protagonistas da produção de conteúdo nesse espaço, participantes ativos de discussões em torno de questões relativas a esse nível de ensino, de forma crítica e interativa. Também faz parte da proposta estimular o diálogo nas escolas e criar oportunidades para que as boas práticas pedagógicas e curriculares sejam divulgadas. Assim, a partir delas, espera-se que surjam produtivos modos de conversação, entendimento, troca de experiências e busca de soluções para eventuais situações vividas nas escolas públicas de ensino médio no Brasil.
O Portal consiste, portanto, em um objeto cibercultural que pode contribuir para a construção de currículos escolares que correspondam às demandas da juventude contemporânea. Para isso, estimula a participação dos jovens, por meio de recursos tecnológicos atrativos".
O link desse portal é: http://www.emdialogo.uff.br/
Gostaram??! Eu espero que sim... Claro que devem participar, como diz o artigo, ativamente! Refletindo sobre isso, relacionei com nosso blog, e essa nossa conversa é super pertinente aqui também... afinal de contas, isso tudo só faz sentido com vocês...
Esse é o perfil da nossa escola, somos todos aprendentes...
REFERÊNCIA:
PRESENÇA PEDAGÓGICA; v. 19; n. 111; mai./jun.2013.
AGRADECIMENTO:
LUIZ PEREIRA DA SILVA
O que diz o artigo? Ele aborda a criação de um portal aberto de interação entre escolas, alunos, professores, pesquisadores objetivando uma atratividade por parte do alunado através das tecnologias digitais. Leiam um trechinho retirado do artigo:
"A Proposta do Portal EM diálogo é de que jovens do ensino médio sejam protagonistas da produção de conteúdo nesse espaço, participantes ativos de discussões em torno de questões relativas a esse nível de ensino, de forma crítica e interativa. Também faz parte da proposta estimular o diálogo nas escolas e criar oportunidades para que as boas práticas pedagógicas e curriculares sejam divulgadas. Assim, a partir delas, espera-se que surjam produtivos modos de conversação, entendimento, troca de experiências e busca de soluções para eventuais situações vividas nas escolas públicas de ensino médio no Brasil.
O Portal consiste, portanto, em um objeto cibercultural que pode contribuir para a construção de currículos escolares que correspondam às demandas da juventude contemporânea. Para isso, estimula a participação dos jovens, por meio de recursos tecnológicos atrativos".
O link desse portal é: http://www.emdialogo.uff.br/
Gostaram??! Eu espero que sim... Claro que devem participar, como diz o artigo, ativamente! Refletindo sobre isso, relacionei com nosso blog, e essa nossa conversa é super pertinente aqui também... afinal de contas, isso tudo só faz sentido com vocês...
Esse é o perfil da nossa escola, somos todos aprendentes...
REFERÊNCIA:
PRESENÇA PEDAGÓGICA; v. 19; n. 111; mai./jun.2013.
AGRADECIMENTO:
LUIZ PEREIRA DA SILVA
INFORMATIVO: Curso de Inglês Online para alunos da Rede Pública
Olá pessoal!
O Governo do Estado de SP está disponibilizando curso de inglês online (Totalmente a distância... entenderam?!?) para vocês... Achei muito interessante! Quando temos essas iniciativas, temos que valorizá-las! São 30 mil vagas, o curso é dividido em 8 módulos que totalizam 16 semanas ininterruptas com carga horária total de 80 horas. Segue o link para os interessados:
http://www.educacao.sp.gov.br/evesp/cursos/
Um abraço!
O Governo do Estado de SP está disponibilizando curso de inglês online (Totalmente a distância... entenderam?!?) para vocês... Achei muito interessante! Quando temos essas iniciativas, temos que valorizá-las! São 30 mil vagas, o curso é dividido em 8 módulos que totalizam 16 semanas ininterruptas com carga horária total de 80 horas. Segue o link para os interessados:
http://www.educacao.sp.gov.br/evesp/cursos/
Um abraço!
BOM RETORNO!!!
Olá meus queridos!
Espero que tenham tido um bom descanso, que tenham aproveitado bastante, e estejam com as energias recarregadas... Um Ótimo Retorno a todos nós, e que esse semestre seja extremamente produtivo!
Um abraço!
Profª. Edileyne
sábado, 22 de junho de 2013
GUIA DAS PROFISSÕES
Olá meus queridos!
Aproveitando o assunto futuro, carreira... resolvi postar para vocês um Guia das Profissões para ajudá-los numa orientação futura... Espero que achem produtivo!!!
Um grande abraço!
http://www.vunesp.com.br/guia2013/
Aproveitando o assunto futuro, carreira... resolvi postar para vocês um Guia das Profissões para ajudá-los numa orientação futura... Espero que achem produtivo!!!
Um grande abraço!
http://www.vunesp.com.br/guia2013/
Informações: Cursinho pré-vestibular
Olá meus queridos!
A medida que o tempo vai passando, começa a preocupação tanto com a carreira que seguirão como com a Universidade que estudarão... Afinal de contas, passarão por lá uns bons anos!
Pensando nisso, resolvi postar informação sobre o Cursinho oferecido pela Universidade Unesp o qual os números falam por si só... Vejam!
Um grande abraço!
REFERÊNCIA:
A medida que o tempo vai passando, começa a preocupação tanto com a carreira que seguirão como com a Universidade que estudarão... Afinal de contas, passarão por lá uns bons anos!
Pensando nisso, resolvi postar informação sobre o Cursinho oferecido pela Universidade Unesp o qual os números falam por si só... Vejam!
Um grande abraço!
REFERÊNCIA:
"Oferecidos gratuitamente, os cursinhos da Unesp preparam os estudantes egressos da rede pública para os exames vestibulares de universidades públicas e particulares. No vestibular de 2010, de 4.586 estudantes dos cursinhos organizados por alunos da Unesp, 1.480 foram aprovados, sendo 1.024 em universidades públicas e 395 em particulares."
SÃO VICENTE
Cursinho Caiçara - Campus do Experimental do Litoral Paulista
Praça Infante Dom Henrique s/nº - Pq Bitarú
cursinhocaicara@clp.unesp.br
Praça Infante Dom Henrique s/nº - Pq Bitarú
cursinhocaicara@clp.unesp.br
sexta-feira, 31 de maio de 2013
1ºs QUÍMICA: ATIVIDADE DE RECUPERAÇÃO
Olá meus queridos! Segue postagem
da Atividade de Recuperação que deve ser entregue seguindo o mesmo combinado do
bimestre anterior! Só para lembrá-los... Os exercícios devem ser copiados e
resolvidos em folha de almaço, onde deve conter o cabeçalho da escola, o nome,
número, série de cada um de vocês, e importantíssimo é ficarem atentos ao prazo
de entrega... No nosso caso até o dia da Prova Bimestral de Química ok?!? Um
grande abraço!
ATIVIDADE
DE RECUPERAÇÃO
1) Os íons Ca2+ e Pb2+ possuem:
(Dados os números atômicos: Ca = 20 e Pb = 82)
a) mesmo número de prótons e elétrons
b) mesmo número de prótons e nêutrons
c) mesma carga nuclear e diferentes massas atômicas
d) igual soma de número de prótons e de nêutrons
e) igual diferença entre número de prótons e elétrons
2) São dados três átomos
distintos A, B e C. O átomo A tem número atômico 35 e número
de massa 80. O átomo C tem 47
nêutrons, sendo isótopo de A. O átomo B é isóbaro de C e isótono de A. Determine
o número de prótons do átomo B.
3) "Os
implantes dentários estão mais seguros no Brasil e já atendem às normas
internacionais de qualidade. O grande salto de qualidade aconteceu no processo
de confecção dos parafusos e pinos de titânio, que compõem as próteses. Feitas
com liga de titânio, essas próteses são usadas para fixar coroas dentárias,
aparelhos ortodônticos e dentaduras, nos ossos da mandíbula e do maxilar." (Jornal do Brasil, outubro de 1996)
Considerando
que o número atómico do titânio é 22, sua configuração eletrônica será:
a) 1s², 2s², 2p6, 3s², 3p3
b) 1s², 2s², 2p6, 3s², 3p5
c) 1s², 2s², 2p6, 3s², 3p6,
4s²
d) 1s², 2s², 2p6, 3s², 3p6,
4s², 3d²
e) 1s², 2s², 2p6, 3s², 3p6,
4s², 3d10, 3p6
4) Na Tabela Periódica, uma das linguagens usadas em
Química, os elementos aparecem representados por um símbolo, referente ao nome,
acompanhado do número atômico e do número de massa. Um professor de Química, ao
trabalhar o tema com seus alunos, propôs o seguinte jogo:
Imagine a Tabela
como um tabuleiro de um jogo em que, para fazer as jogadas, os participantes
deverão sortear bolinhas que indiquem o movimento da pedra do jogador. A
contagem inicia-se no elemento de número atômico 1, e o vitorioso será aquele
que chegar primeiro ao número atômico 118. Iniciada a partida, um aluno sorteou
as bolinhas que indicavam as seguintes jogadas:
·
1a jogada: 4V (andar quatro
casas na vertical)
·
2a jogada: 7H (andar sete casas
na horizontal para a direita)
·
3a jogada: 4H (andar quatro
casas na horizontal para a direita)
·
4a jogada: 2V (andar duas casas
na vertical)
· 5a jogada: 2H (andar duas casas
na horizontal para a direita)
(A) 1a jogada, encontramos o elemento que é o principal
componente do sal de cozinha.
(B) 2a jogada, encontramos o elemento que é o principal
componente do aço.
(C) 3a jogada, encontramos o elemento que é o principal
componente do bronze.
(D) 4a jogada, encontramos um metal sólido em temperatura
ambiente.
(E) 5a jogada, encontramos um metal líquido em temperatura
ambiente.
* Obs:
Justifique sua resposta! Não vale só assinalar ok?!?
5) Represente as ligações abaixo de acordo
com os elementos propostos:
a) 13Al e 9F
a) 13Al e 9F
b) 30Zn e
17Cl
6) Quanta (Gilberto Gil)
"“Fragmento infinitésimo
Quase apenas mental
Quantum granulado no mel
Quantum ondulado do sal
Mel de urânio, sal de rádio
Qualquer coisa quase ideal”
quinta-feira, 30 de maio de 2013
1ºs QUÍMICA: LIGAÇÕES QUÍMICAS I
Olá queridos!
Vamos falar sobre Ligações químicas? Segue esse link mais explicativo que aplicativo,
entretanto numa linguagem bem simples, bem dinâmico! Espero que gostem!
Um grande
abraço!
http://www.youtube.com/watch?v=s_Ca1mk1I9E
1ºs QUÍMICA: DISTRIBUIÇÃO ELETRÔNICA
Olá meus anjinhos!
Apesar de fazermos alguns exercícios em sala, para que não tenham realmente nenhuma
dúvida, resolvi postar uma vídeo-aula sobre Distribuição Eletrônica! Escolhi
esse link que considero muito bom...
Um grande abraço!
http://www.youtube.com/watch?v=ktX2LrWNuTY
1ºs. QUÍMICA: TABELA PERIÓDICA
Olá meus alunos
dos 1ºs.! Como conversei com vocês em sala, segue postagem sobre a
Tabela Periódica! Escolhi esse link produzido pela PUC Rio em parceria com o
Ministério da Educação, Ministério da Educação e Tecnologia e o Fundo Nacional
de Desenvolvimento da Educação por tratar o tema em uma linguagem bem simples,
de fácil entendimento. Aproveitem!!! Um grande abraço!
http://www.youtube.com/watch?v=hvRnuMrDc14
1ºs QUÍMICA: MODELOS ATÔMICOS
Boa noite meus
queridos! Hoje nosso tema são os Modelos
Atômicos! Primeiro temos que pensar que ao desenrolar da História, diversos
cientistas e estudiosos tentaram definir e entender a constituição da matéria,
e justamente devido a isso, diversas teorias surgiram. Importante é refletirmos
que um cientista à medida que discorda ou acrescenta informações ao modelo
anterior, está caminhando em prol do desenvolvimento da Ciência. Espero que gostem... Um grande abraço!
http://www.youtube.com/watch?v=58xkET9F7MY
domingo, 19 de maio de 2013
FÍSICA 2ºs. B e C : EXERCÍCIOS DE FIXAÇÃO
Olá meus queridos! Vocês poderão imprimir ou copiarem esses exercícios e deverão resolvê-los em folha separada e entregarem na próxima semana ok?! Valerão pontos para esse bimestre...
 À noite, ocorre um processo inverso
ao que se verifica durante o dia.
À noite, ocorre um processo inverso
ao que se verifica durante o dia.
EXERCÍCIOS
1) (Enem-MEC) Uma garrafa de
vidro e uma lata de alumínio, cada uma contendo 330mL de refrigerante, são
mantidas em um refrigerador pelo mesmo longo período de tempo. Ao retirá-las do refrigerador com as mãos
desprotegidas, tem-se a sensação de que a lata está mais fria que a garrafa. É
correto afirmar que:
a) a lata está realmente mais
fria, pois a cidade calorífica da garrafa é maior que a da lata.
b) a lata está de fato menos
fria que a garrafa, pois o vidro possui condutividade menor que o alumínio.
c) a garrafa e a lata estão à
mesma temperatura, possuem a mesma condutividade térmica, e a sensação deve-se
à diferença nos calores específicos.
d) a garrafa e a lata estão à
mesma temperatura, e a sensação é devida ao fato de a condutividade térmica do
alumínio ser maior que a do vidro.
e) a garrafa e a lata estão à
mesma temperatura, e a sensação é devida ao fato de a condutividade térmica do
vidro ser maior que a do alumínio.
2) (UFCAR-SP) Nas geladeiras o
congelador encontra-se na parte superior. Nos pólos, as construções são feitas
sob o gelo. Os viajantes do deserto do Saara usam roupas de lã durante o dia e
à noite. Relativamente ao texto acima, qual das afirmações abaixo não é
correta?
a) O gelo é mau condutor de
calor.
b) A lã evita o aquecimento do
viajante do deserto durante o dia e o resfriamento durante a noite.
c) A lã impede o fluxo de calor
por condução e diminui as correntes de convecção.
d) O gelo, sendo um corpo a
0ºC, não pode dificultar o fluxo de calor.
e) O ar é um ótimo isolante
para o calor transmitido por condução, porém favorece muito a transmissão do
calor por convecção.
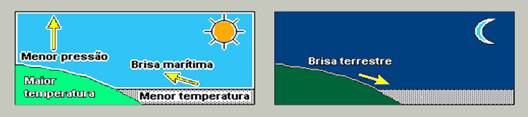
3) (ENEM-MEC) Numa área de
praia, a brisa marítima é uma conseqüência da diferença no tempo de aquecimento
do solo e da água, apesar de ambos estarem submetidos às mesmas condições de
irradiação solar. No local (solo) que se aquece mais rapidamente, o ar fica
mais quente e sobe, deixando uma área de baixa pressão, provocando o
deslocamento do ar da superfície que está mais fria (mar).
 À noite, ocorre um processo inverso
ao que se verifica durante o dia.
À noite, ocorre um processo inverso
ao que se verifica durante o dia.
Como a água leva mais tempo
para esquentar (de dia), mas também leva mais tempo para esfriar (à noite), o
fenômeno noturno (brisa terrestre) pode ser explicado da seguinte maneira:
a) O ar que está sobre a água
se aquece mais; ao subir, deixa uma área de baixa pressão, causando um
deslocamento de ar do continente para o mar.
b) O ar mais quente desce e se
desloca do continente para a água, a qual não conseguiu reter calor durante o
dia.
c) O ar que está sobre o mar se
esfria e dissolve-se na água; forma-se, assim, um centro de baixa pressão, que
atrai o ar quente do continente.
d) O ar que está sobre a água
se esfria, criando um centro de alta pressão que atrai massas de ar
continental.
e) O ar sobre o solo, mais
quente, é deslocado para o mar, equilibrando a baixa temperatura do ar que está
sobre o mar.
4) (PUC-SP) Calor é uma forma
de energia que se transfere de um corpo para outro em virtude de uma diferença
de temperatura entre eles. Há três processos de propagação de calor: condução,
convecção e radiação. Em relação à transferência de calor, afirma-se que:
I. Em dias frios, os pássaros
costumam eriçar suas penas para acumular ar entre elas. Nesse caso, o ar
acumulado constitui-se em um bom
isolante térmico diminuindo as trocas de calor, por condução, com o ambiente.
II. Correntes de convecção na
atmosfera costumam ser aproveitadas por aviões planadores e asas delta para
ganharem altura. Tais correntes são originadas por diferenças de temperaturas
entre duas regiões quaisquer da Terra.
III. As paredes internas das
garrafas térmicas são espelhadas com o objetivo de diminuir as trocas de calor
por radiação.
Está correto o que se afirma em
a) I, II e III. b)
apenas I e II. c) apenas I e
III. d) apenas II e III. e) apenas III.
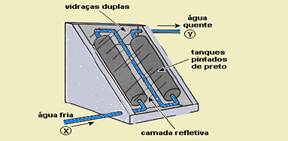
5) (ENEM-MEC) O uso mais popular de energia
solar está associado ao fornecimento de água quente para fins domésticos. Na
figura a seguir, é ilustrado um aquecedor de água constituído de dois tanques
pretos dentro de uma caixa termicamente isolada e com cobertura de vidro, os
quais absorvem energia solar.

A. Hinrichs e M. Kleinbach. "Energia e meio ambiente".
São Paulo: Thompson, 3 ed., 2004, p. 529 (com adaptações).
Nesse sistema de aquecimento,
a) os tanques, por serem de cor preta, são maus absorvedores de
calor e reduzem as perdas de energia.
b) a cobertura de vidro deixa passar a energia luminosa e reduz
a perda de energia térmica utilizada para o aquecimento.
c) a água circula devido à variação de energia luminosa existente
entre os pontos X e Y.
d) a camada refletiva tem como função armazenar energia
luminosa.
e) o vidro, por ser bom condutor de calor,
permite que se mantenha constante a temperatura no interior da caixa.
Assinar:
Comentários (Atom)